ОГЭ. Электролиты. Сила электролита
Задания сайта ФИПИ на эту тему можно прорешать в курсе самостоятельной подготовки к ОГЭ.
Электролиты - это вещества, растворы или расплавы которых проводят электрический ток (обладают ионной проводимостью). Это соли, кислоты, основания.
В электролитах имеются ионные или ковалентные сильнополярные связи. Например:
NaOH, Ca(OH)2, H2SO4, HNO3, HNO2, Na3PO4, NaCl и многое другие.
Неэлектролиты - это вещества, растворы и расплавы которых не проводят электрический ток (не обладают ионной проводимостью), например оксиды, многие органические вещества (эфир, углеводы, бензол и др.). В молекулах этих веществ действуют ковалентные неполярные или малополярные связи. Например:
CO2, Na2O, CCl4, CH4, C6H12O6, спирты и многие другие.
Электролитическая диссоциация - это распад электролита на ионы при его растворении или расплавлении. На следующей картинке схематично показан процесс диссоциации соли NaCl: молекулы воды подходят в кристаллу, окружают ионы Na+ и Cl− и отрывают их от исходного кристалла.
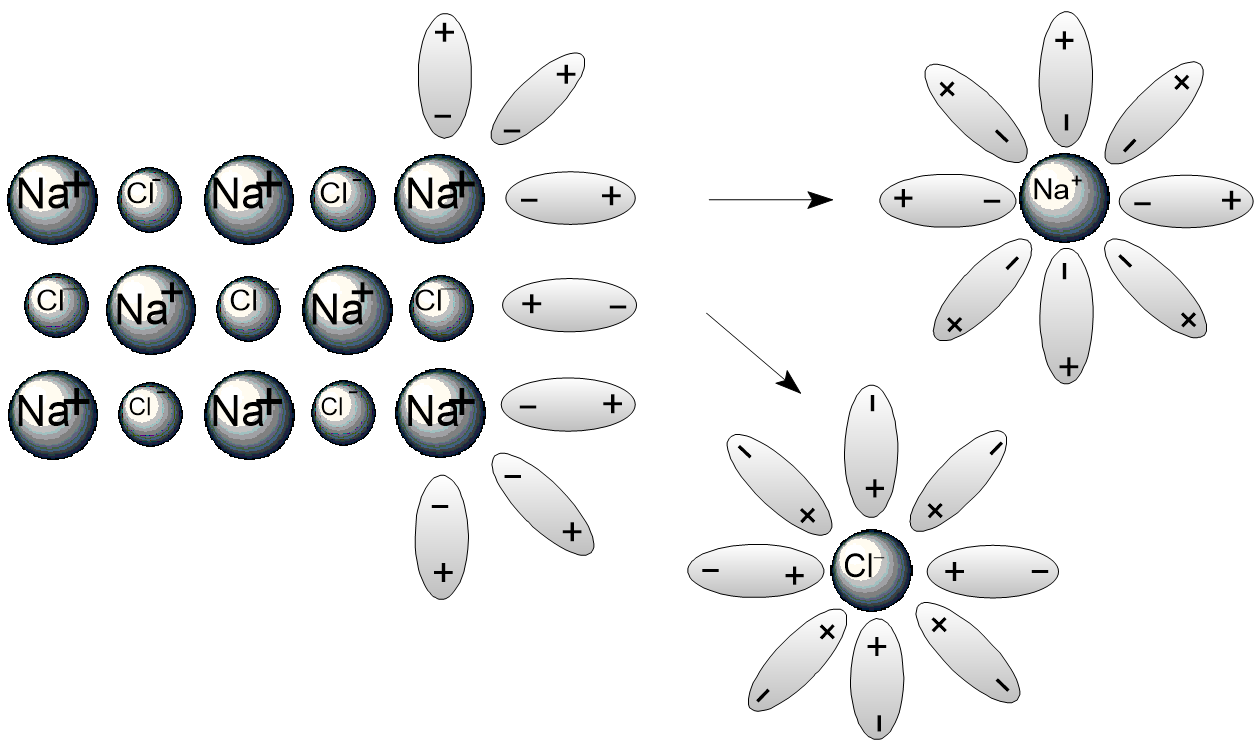
Молекулы воды являются полярными, т.е. на атоме кислорода сосредоточен частичный отрицательный заряд, а на атомах водорода частичный положительный заряд. Поэтому схематично эти молекулы изображают в виде овала с зарядами + и − на двух концах. Ионы в водном растворе находятся не в свободном состоянии, а связаны с молекулами воды, т.е. являются гидратированными.
Гидратированные ионы - это ионы, окруженные молекулами воды, образующиеся при растворении электролитов в воде.
Рассмотрим диссоциацию соединения с ковалентной полярной связью - HCl.
При растворении HCl в воде молекулы воды окружают молекулы хлороводорода и изменяют характер связи в молекуле. Сначала связь становится более полярной, а затем переходит в ионную связь как результат диссоциации электролита в воде:
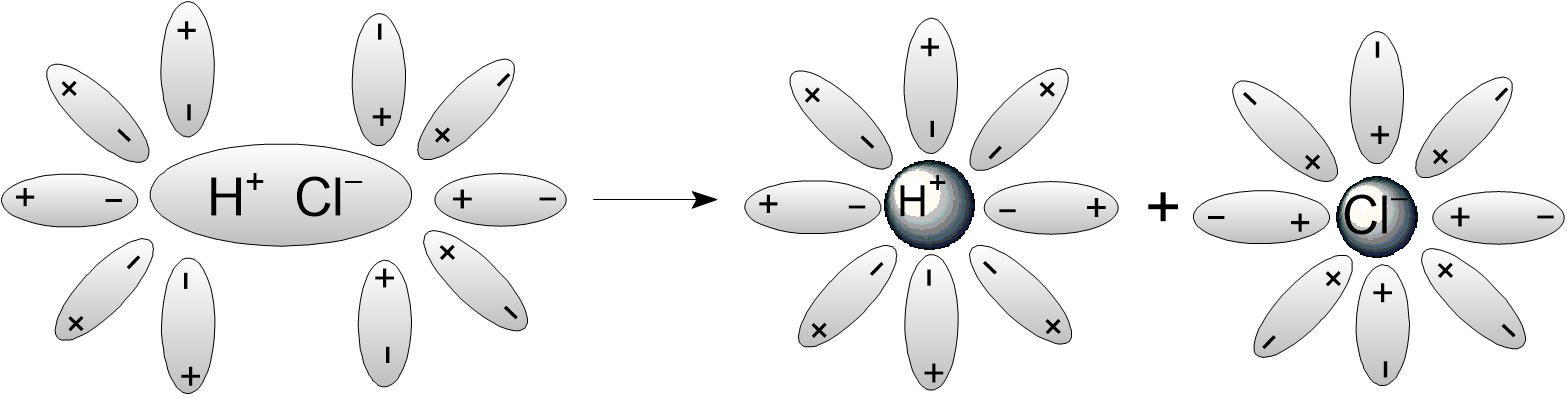
HCl -> H+ + Cl−.
В качестве еще одного примера рассмотрим серную кислоту. Если, например, в разбавленном растворе имеются 1000 молекул H2SO4, то все они диссоциируют на ионы H+ и HSO4− (так как степень диссоциации равна 100%). Исходных молекул H2SO4 в растворе нет вообще, только ионы, окруженные молекулами воды (гидратированные). Такие электролиты называются сильными, т.е. те, которые в растворе полностью или практически полностью распадаются на ионы.
Сильные электролиты:
1. Почти все соли, включая нерастворимые. Даже если соль является нерастворимой, какое-то очень небольшое количество этой соли обязательно растворится и продиссоциирует на ионы полностью.
2. Многие неорганические кислоты: HNO3, H2SO4, HCl, HBr, HI и некоторые другие.
3. Гидроксиды щелочных и щелочно-земельных металлов: NaOH, Ca(OH)2, Ba(OH)2 и другие.
Например:
Ca(OH)2 -> 2OH− + Ca2+.
HCl -> H+ + Cl−.
Слабые электролиты:
1. Почти все органические кислоты и вода.
2. Некоторые неорганические кислоты: HF, H2S, H2SO3, HNO2, H2CO3, H3PO4 и некоторые другие.
3. Нерастворимые гидроксиды металлов: Al(OH)3, Mg(OH)2, Fe(OH)2, Fe(OH)3, Zn(OH)2 и другие; гидрат аммиака NH3·H2O.
Слабые электролиты диссоциируют обратимо, т.е. в водном растворе присутствуют как исходные молекулы, так и продукты диссоциации - гидратированные ионы.
Например:
H2S ⇔ H+ + HS–.
Нерастворимые гидроксиды металлов, конечно, хоть немного, но растворятся. Но то, что смогло растворится не будет распадаться на ионы. Поэтому нерастворимые гидроксиды являются слабыми электролитами, а нерастворимые соли - сильными электролитами. Так как, как обсуждалось выше, та небольшая часть соли, которая все таки смогла раствориться, полностью распадется на ионы.
