Распределение электронов по орбиталям
Основное (устойчивое) состояние атома - это такое состояние, которое характеризуется минимальной энергией. Поэтому электроны заполняют орбитали в порядке увеличения их энергии.
Вспомним порядок заполнения подуровней электронами:
1s → 2s → 2p → 3s → 3p → 4s → ...
На каждом из подуровней может находиться определенное количество электронов: s-подуровень представляет собой одну орбиталь, на которой могут находиться максимум два электрона; p-подуровень состоит из трёх орбиталей, а максимальное число электронов - 6:
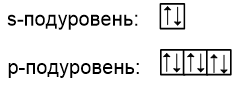
Но как правильно распределить электроны по орбиталям в пределах одного подуровня?
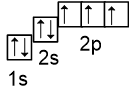
Согласно правилу Гунда сначала на каждой орбитали одного подуровня размещается по одному электрону (стрелкой вверх), затем в каждую из орбиталей помещают по второму электрону (стрелка вниз). Рассмотрим пример заполнения орбиталей в атоме кислорода. Порядковый номер в периодической таблице равен 8, следовательно по орбиталям нужно разместить 8 электронов. Орбитали (клеточки) рисуем снизу вверх, т.е. внизу всегда находится 1s-подуровень, имеющий наименьшую энергию. Выше этого подуровня рисуем следующий 2s-подуровень и далее 2p-подуровень.
Сначала поместим 2 электрона на первую s-орбиталь, затем 2 электрона на 2s-орбиталь, затем 3 электрона на каждую из трёх орбиталей 2p-подуровня (разместили 7 электронов из 8):
На последнем шаге поместим 8-ой электрон на первую орбиталь 2p-подуровня стрелкой вниз:
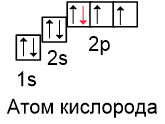
Вспомним, что два электрона, находящиеся на одной орбитали, называются спаренными (или неподелённой электронной парой). Если электрон на орбитали один, его называют неспаренным.
Расставляя электроны таким образом, получаем основное состояние атома. Следовательно, в основном состоянии в атоме кислорда есть 2 неспаренных электрона.
