ЕГЭ. Закономерности изменений свойств элементов в периодической таблице и их соединений
Задания открытого банка ФИПИ на эту тему можно прорешать в данном уроке.
Как изменяются свойства элементов в главных подгруппах?
Неметаллические и окислительные свойства определяются способностью атомов притягивать (принимать) электроны. Эта способность уменьшается в группах сверху вниз. Почему? Это легче всего понять, посмотрев на следующую картинку.
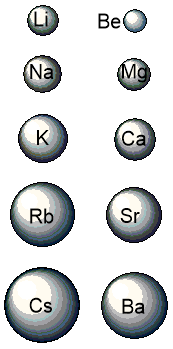
Как мы видим, радиусы атомов сверху вниз увеличиваются (так как увеличивается число заполненных электронных слоев), внешние электроны находятся все дальше и дальше от ядра, притяжение к положительно заряженному ядру атома уменьшается. Поэтому и уменьшается способность атомов принимать (притягивать) электроны. Следовательно, неметаллические свойства простых веществ, образованных этими элементами, в главных подгруппах сверху вниз также уменьшаются.
Металлические и восстановительные свойства - это способность атомов отдавать электроны. Эти свойства возрастают в группах сверху вниз. Это объясняется тем, что чем больше радиус атома, тем легче атому отдавать электроны.
Как изменяются свойства оксидов и гидроксидов в группах сверху вниз?
Кислотные свойства оксидов и гидроксидов определяются неметаллическими свойствами простых веществ, образованных их центральными элементами. Т.е. если их неметаллические свойства в группе сверху вниз ослабевают, то и кислотные свойства их соединений (оксидов и гидроксидов) также будут ослабевать.
Основные свойства оксидов и гидроксидов определяются металлическими свойствами и изменяются в противоположную сторону, т.е. в группах сверху вниз они усиливаются.
В качестве примера рассмотрим ряд HNO3, H3PO4, H3AsO4. Согласно рассуждениям выше, кислотные свойства в этом ряду ослабевают, так как ослабевают неметаллические свойства в ряду N -> P -> As (по группе сверху вниз).
Некоторые металлы и неметаллы образуют несколько оксидов и гидроксидов. Высшими называются те, в которых степень окисления соответствующего металла или неметалла равна номеру группы. Например, азот, находящийся в 5-ой группе периодической таблицы, образует несколько оксидов: N2O, NO, N2O3, NO2 и N2O5, но только N2O5 является высшим оксидом, так как в нем степень окисления равна +5 (т.е. номеру группы).
Кислотные свойства водородных соединений (бескислородных кислот)
Рассмотрим ряд соединений (а точнее их водные растворы): HF, HCl, HBr, HI. Двигаясь по группе сверху вниз, размер атомов F, Cl, Br, I увеличивается (так как растет число электронных слоев). В результате чего связь H-Г (Г - галоген) ослабевает и удлиняется. Так как эта связь становится слабее (в группе сверху вниз), кислота становится сильнее (так как становится все проще и проще отщепить протон).
Как изменяются свойства элементов по периоду?
По периоду наблюдаем увеличение зарядов ядер атомов и, следовательно, увеличение числа электронов на внешнем уровне. Это приводит к усилению взаимодействия внешней оболочки с ядром и к уменьшению атомного радиуса:
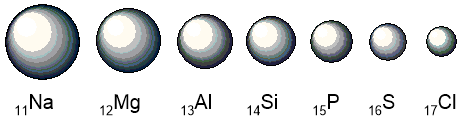
Неметаллические свойства определяются способностью атомов притягивать электроны. Так как внешние электроны вдоль периода слева направо сильнее притягиваются к ядру, им легче принимать недостающие электроны, а отдавать сложнее. Поэтому неметаллические свойства увеличиваются, а металлические, наоборот, уменьшаются.
Кислотные свойства оксидов и гидроксидов определяются неметаллическими свойствами образующих их элементов. Следовательно, наблюдаем ослабление по периоду основных свойств оксидов и гидроксидов и усиление их кислотных свойств.
Кислотные свойства водородных соединений неметаллов по периоду слева направо также увеличиваются, так как неметаллические свойства их элементов возрастают. Например, в ряду NH3, H2O, HF наблюдается усиление кислотных свойств.
Обобщим вышесказанное в следующей таблице. Стрелками показано увеличение свойств в периодической таблице:
| Свойства | Изменение в периодической таблице |
|---|---|
| Окислительные и неметаллические свойства | 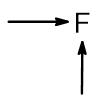 |
| Кислотные свойства оксидов и гидроксидов |  |
| Восстановительные и металлические свойства | 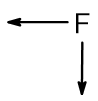 |
| Основные свойства оксидов и гидроксидов |  |
Кислотные свойства кислородсодержащих кислот в зависимости от степени окисления центрального элемента
Полярность связи O-H играет ключевую роль в определении кислотных свойств кислородсодержащих кислот. Она в свою очередь зависит от центрального атома (его способности притягивать электроны) и от количества негидроксильных атомов кислорода. В нашем случае центральные атомы одинаковые, т.е. все зависит от негидроксильных атомов кислорода. Чем больше таких атомов, тем сильнее они оттягивают электронную плотность со связи O-H, делая её более полярной, а кислоту более сильной.
В качестве примера рассмотрим ряд кислородсодержащих кислот хлора.

Согласно рассуждениям выше, сила кислот сверху вниз увеличивается: HClO и HClO2 - слабые, а HClO3 и HClO4 - сильные кислоты.
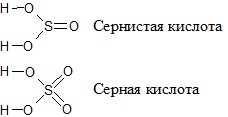
Аналогично, серная кислота является более сильной, чем сернистая.