4. Химические свойства соединений фосфора с точки зрения изменения степеней окисления
Кратко все основные правила составления ОВР для 2-ой части экзамена, представлены в другом разделе.
Потренироваться составлять реакции онлайн (в рамках ЕГЭ) можно тут.
Правило 4.1. P2O5 активно отнимает воду, поэтому используется для получения оксидов:
P2O5 + 2HNO3 -> N2O5 + 2HPO3
P2O5 + 2HClO4 -> Cl2O7 + 2HPO3
Правило 4.2. Степень окисления +5 – это наиболее устойчивая степень окисления фосфора, поэтому, как правило, соединения фосфора в других степенях окисления окисляются до ст. ок. +5:
3P2O3 + 4HNO3 + 7H2O -> 6H3PO4 + 4NO
P2O3 + 4HNO3 + H2O → 2H3PO4 + 4NO2
3P2O3 + 2HClO3 + 9H2O -> 6H3PO4 + 2HCl
3P2O3 + 2NaClO3 -> 3P2O5 + 2NaCl
3PCl3 + 2HNO3 + 8H2O -> 3H3PO4 + 2NO + 9HCl
5H3PO3 + 2KMnO4 + 3H2SO4 -> 5H3PO4 + K2SO4 + 2MnSO4 + 3H2O или
15H3PO3 + 6KMnO4 + 3H2SO4 -> 11H3PO4 + 3K2SO4 + 2Mn3(PO4)2↓ + 9H2O
Окисление KH2PO2 (гипофосфита калия) бромной водой:
KH2PO2 + 2Br2 + 2H2O → H3PO4 + KBr + 3HBr.
Правило 4.3. Фосфор в фосфине также окисляется до P+5 :
2PH3 + 4O2 -> P2O5 + 3H2O или PH3 + 2O2 -> H3PO4
PH3 + 8KMnO4 + 11KOH -> K3PO4 + 8K2MnO4 + 7H2O
5PH3 + 8KMnO4 + 12H2SO4 -> 5H3PO4 + 4K2SO4 + 8MnSO4 + 12H2O
PH3 + 8AgNO3 + 4H2O -> 8Ag + H3PO4 + 8HNO3
PH3 + 4HClO -> H3PO4 + 4HCl
8HNO3(конц., гор.) + PH3 -> H3PO4 + 8NO2↑ + 4H2O
Правило 4.4. Галогениды фосфора гидролизуются водой или раствором щелочи:
PCl3 + 3H2O -> H3PO3 + 3HCl
PCl5 + 4H2O -> H3PO4 + 5HCl
PI3 + 3H2O -> H3PO3 + 3HI
PCl5 + 8KOH -> K3PO4 + 5KCl + 4H2O
Правило 4.5. Фосфиды металлов разлагаются водой или кислотами, образуя фосфин:
Ca3P2 + 6H2O -> 3Ca(OH)2 +2PH3↑
Zn3P2 + 6HCl -> 3ZnCl2 + 2PH3↑
Mg3P2 + 6H2O -> 3Mg(OH)2 +2PH3↑
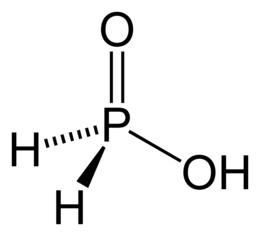
Правило 4.6. В таблице ниже представлены формулы и строение различных кислот фосфора.
По словам составителей экзамена основность и строение кислот H3PO3 и H3PO2 на ЕГЭ проверяться не будет. Но они могут встретиться тестовой части, например, в задании 5, т.е. необходимо знать класс этих соединений (кислоты).
Такие кислоты как фосфористая H3PO3 и фосфорноватистая H3PO2 образуют только соли, содержащие один и два атома водорода. Это происходит из-за того, что в этих кислотах есть атомы водорода, соединённые непосредственно с атомом фосфора, а они на металл не заменяются. Например:
P4 + 3KOH + 3H2O -> PH3 + 3KH2PO2 (гипофосфит калия)
|
Степень окисления P |
Формула кислоты |
Название кислоты |
Название солей |
Строение кислоты |
|---|---|---|---|---|
|
P+5 (V) |
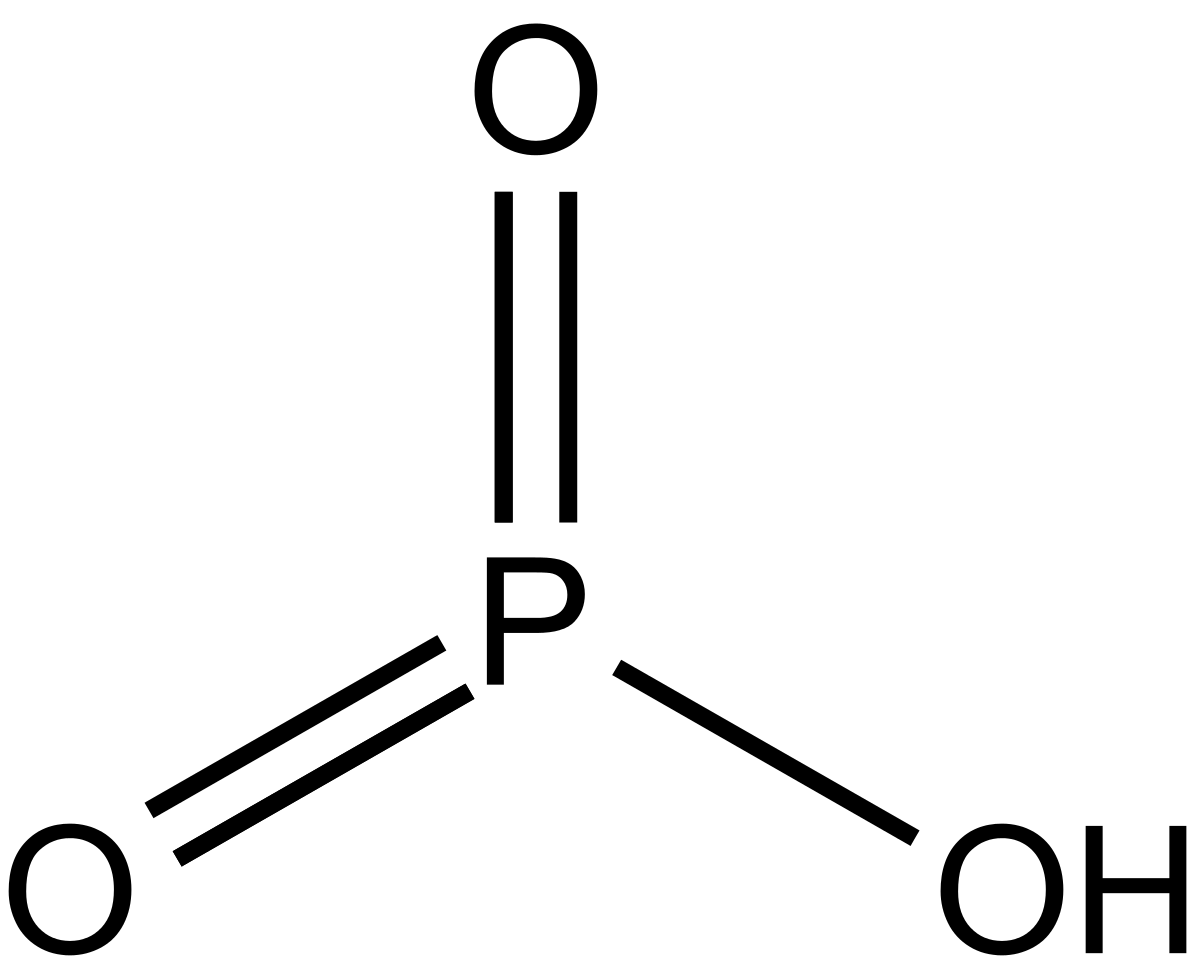
HPO3 |
Метафосфорная |
Метафосфаты, PO3– |
|
|
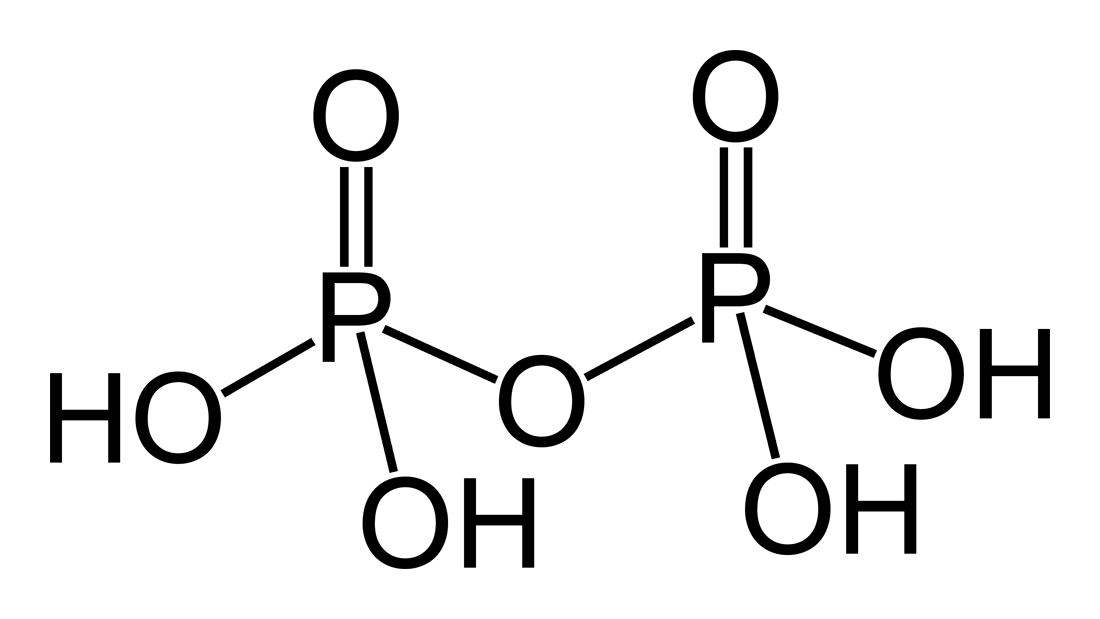
H4P2O7 |
Пирофосфорная |
Пирофосфаты, P2O74– |
|
|
|
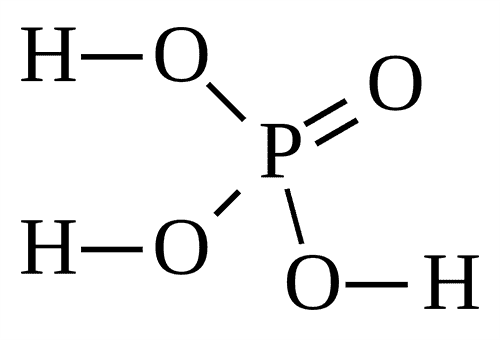
H3PO4 |
Ортофосфорная |
(Орто)фосфаты, PO43– |
|
|
|
P+3 (V) |
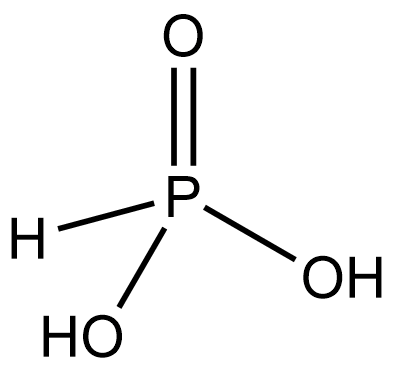
H3PO3 |
Фосфористая (фосфоновая) |
Фосфиты, HPO32– (фосфонаты) |
|
|
P+1 (V) |
H3PO2 |
Фосфорноватистая (фосфиновая) |
Гипофосфиты, H2PO2– (фосфинаты) |
|