Заметки из вебинаров
В апреле 2025 года разработчиками КИМ ЕГЭ был проведен очередной вебинар "Организация подготовки учащихся к Государственной итоговой аттестации по химии", который был полностью посвящен ответам на вопросы. Основные вопросы и краткие ответы, которые обсуждались на данном вебинаре, представлены на этой странице.
Ссылка на вебинар на сайте RuTube.ru
Краткое содержание вебинара:
1. Не нужно брать перманганат для того, чтобы перевести хром из ст. ок. +3 в ст. ок +6. Окислительной способности перманганата не хватает, чтобы эта реакция прошла с хорошим выходом.

2. Наименьшее общее кратное в электронном балансе писать необязательно. Если в реакции участвует простое вещество, например Br2, в электронном балансе можно написать один атом.

3. Важнейшие окислители и восстановители:

4. При оформлении задания 30 цифру 1 в зарядах ионов писать не нужно.
5. Пример оформления задачи на продукты сгорания:

6. Пример оформления задачи, если даны массовые доли:
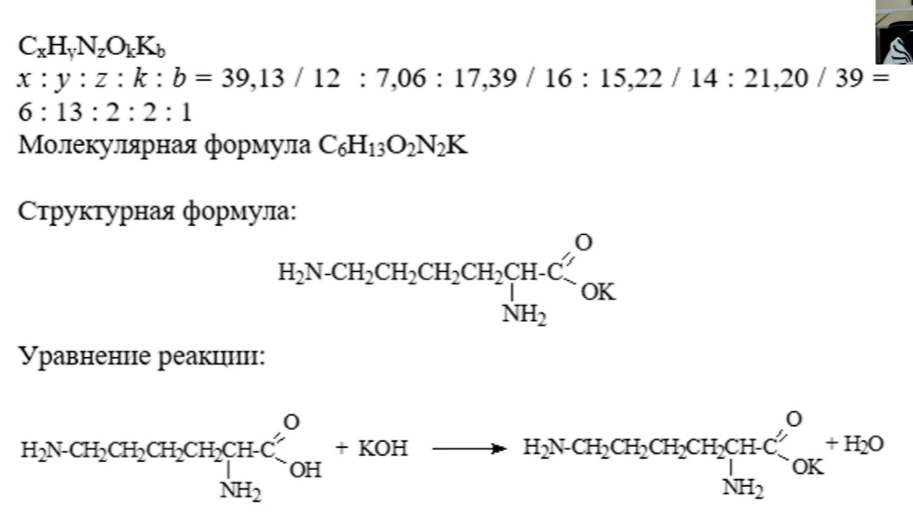
7. Алюминат щелочного металла является средней солью. Может встретиться в заданиях ЕГЭ.
8. Железная окалина - смешанный оксид.
9. В такой формулировке задания предполагается, что число правильных вариантов может быть 2, 3 или 4 (не 1 и не все 5):

10. В следующем задании равновесие практически не смещается:
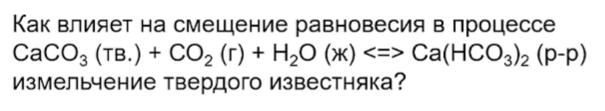
11. Реакция возможна, но во второй части её не будет:

12. Нет.

13. Реакция протекает, но образуется полимер, поэтому реакцию написать не попросят.
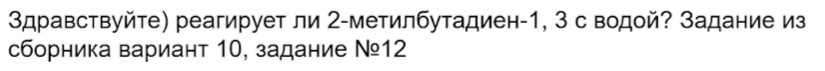 \
\
14. Нет.

15. Можно.

16. Ферраты в ЕГЭ могут быть, но не во второй части (в задании на классификацию).
17. Можно написать как среднюю соль, так и кислую.

18. Комплекс образуется только в избытке щёлочи. Но если в продуктах записать комплекс (тетра- или гекса-), ответ также будет считаться верным.

19. Можно писать любой вариант:

20. Cu(OH)2 реагирует с муравьиной и бензойной кислотами при обычных условиях:

21. Равновесие смещается, так как ионы H+ реагируют с нерастворимым основанием:

22. Необходимости два раза писать ионное уравнение нет:
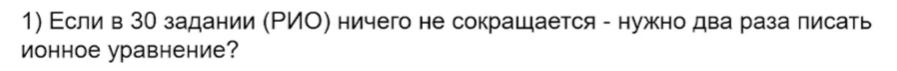
23. ZnS оставляем. С избытком углекислого газа будет кислая соль:

24. Во второй части глюкоза может встретиться в реакции спиртового брожения. В этом случае можно (и должны) написать молекулярную формулу C6H12O6.

25. Цифры в ответе в 23 задании повторятся могут, но, как правило, этого не происходит.
26. При взаимодействии сероводорода и сульфидов с перманганатом калия образуется сера, лучше писать её:

27. Реакция сомнительная, и сейчас такие точно не встретятся:
28. Тривиальные названия:

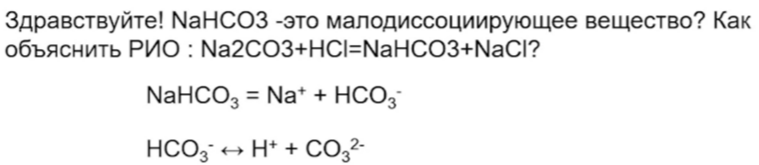
29. В этой реакции осаждается FeS, лучше писать первую реакцию:

30. Про механизмы реакций лучше детям рассказывать. Термины нуклеофил и электрофил на ЕГЭ не встретятся. Могут встретиться вопросы о механизме, например, радикальный или ионный.
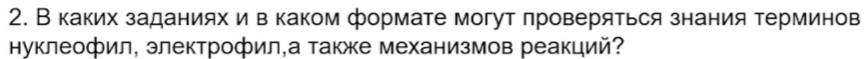
31. Возможные записи: CH3NH3Cl, CH3NH3+Cl−, [CH3NH3]+Cl−.

32. Во второй части экзамена могут встретится только глицин и аланин. Другие аминокислоты - на уровне ознакомления.

33. У лития аномальное расположение в электрохимическом ряду из-за высокой энергии гидратации. Когда мы сравниваем активность щелочных и щелочно-земельных металлов, то ориентироваться нужно на их положение в периодической таблице.

34. По первой ступени NaHCO3 - сильный электролит, так как диссоциирует практически нацело. Сам гидрокарбонат-ион - это малодиссоциирующее вещество. Такое задание в ЕГЭ не встретится.
35. Во второй части ЕГЭ этих реакций не будет. В случае глюкозы - в реакциях можно писать C6H12O6. Заданий на энантиомеры не будет.

36. Исключение, т.е. реакция азота с кислородом, будет.
37. В 29-ом задании удвоенные коэффициенты допускаются. В 30 задании коэффициенты сократить нужно.

38. Можно, но кроме 30-го задания.

39. Эти соединения на ЕГЭ не встретятся.

40. В 21 задании таких соединений нет, но могут встретиться гидрокарбонаты натрия и калия, растворы которых имеют щелочную среду.

41. Щёлочи - сильные растворимые и малорастворимые основания (для задания 5). Растворы аммиака, аминов и гидроксид таллия I к щелочам не относятся.

42. В 5 задании эти соли встретиться могут, но кислые они или средние точно не спросят.

43. Повторите электролиз по Кольбе. Что такое трет-бутил. Первичные, вторичные, третичные и четвертичные атомы углерода.

44. Много внимания этому уделять не стоит.
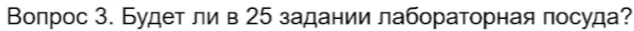
45. Этих реакций не будет. Из комплексов только могут встретиться гидроксокомплексы цинка и алюминия и аммиачный раствор оксида серебра (гидроксид диамминсеребра [Ag(NH3)2]OH).

46. Любое основание с любой кислотой:

47. Если помните, лучше написать. Если не помните, то лучше не писать.

48. Да, реакция протекает и с HCl и с HBr.

49. Глицин образует разные типы кристаллов и про это вопросов на ЕГЭ не будет. Также не спросят про водородные связи в глицине.
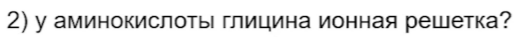
50. На ЕГЭ такие реакции будут вряд ли и лучше писать окисления до брома, а не до HBrO3:
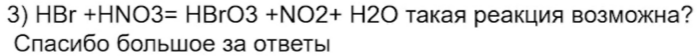
51. Нужно знать какие удобрения бывают: калийные, азотные и фосфорные. KCl, KNO3 - это удобрения. NH4NO3 - азотное удобрение. Кислые фосфаты также являются удобрениями (Ca(H2PO4)2, CaHPO4).

52. Гидрат аммиака - это не газ, поэтому NH3·H2O писать нельзя, если сказано, что выделяется газ. В этом случае нужно писать NH3 + H2O.
Если сказано, что образуется слабый электролит, то можно написать NH3·H2O или даже NH4OH.

53. Первые две реакции не протекают, третья протекает с образованием CaSO4, а также гидро- или дигидрофосфата кальция.

54. В тестовой части эти реакции могут встретиться.

55. Это вещества немолекулярного строения и такие задания на ЕГЭ не встретятся.
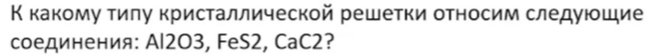
56. Нет, не взаимодействует.

57. Нет.
58. Щелочь на катоде образуется, а СО2 на аноде, поэтому их и пишут отдельно. Если перемешать, то можно написать кислую соль, но о перемешивании нужно написать.

59. Нет.

60. Хлориды вряд ли окисляются азотной кислотой. В реакции бромидов и йодидов с концентрированной азотной кислотой образуется NO2.

61. Первую реакцию рассматриваем по аналогии в одноатомными спиртами. Вторая реакция протекает.

62. Да, эти реакции могут встретиться.

63. Гетероциклов не будет, задач 34 на электролиз соли металлов средней части не будет.

64. Авторы дают такие задания для тренировки, на ЕГЭ их не будет.

